cours:residanat:pneumologie:prise_en_charge_de_l_asthme_au_long_cours
Table des matières
Prise en charge de l'asthme au long cours
Objectifs pédagogiques :
- Savoir établir le diagnostic positif et différentiel d'un asthme
- Éliminer les pathologies respiratoires non asthmatiques (BPCO, DDB, OAP…)
- Savoir évaluer la sévérité de l'asthme
- Savoir mettre en place le traitement de fond
- Organiser la prise en charge de l'asthme au long cours (thérapeutique, contrôle et suivi)
- Savoir définir les objectifs et modalités de surveillance du traitement de fond de l'asthmatique
- Savoir évaluer le contrôle de l'asthme
- Savoir identifier les principales causes de non contrôle de l'asthme
- Connaître les mesures d'évictions allergéniques
1. Définition et généralités
- Définition : Maladie hétérogène, le plus souvent caractérisée par une inflammation chronique des voies aériennes, et définie par des symptômes respiratoires (sibilants, dyspnée, oppression thoracique et toux) variables dans le temps et en intensité ET une limitation variable des débits expiratoires
- Fréquente (1 à 18% de la population, selon les pays)
- La variation des symptômes et de la fonction respiratoire est souvent provoquée par différents facteurs (exercice, allergènes et irritants, changement de météo, infections virales…)
- Peut se résoudre spontanément ou en réponse aux traitements, peut aussi être absente pendant plusieurs semaines/mois
- Les exacerbations (crises d'asthme) peuvent parfois mettre en jeu le pronostic vital
- Asthme souvent associé avec une hyper-réactivité bronchique et une inflammation chronique des voies aériennes : ces 2 dernières persistent même quand les symptômes sont absent ou quand la fonction respiratoire est normale ; ils peuvent se normaliser sous traitement
2. Phénotypes d'asthme
- Maladie hétérogène ⇒ mécanismes physiopathologiques sous-jacents variés
- ⇒ Phénotypes nombreux, les plus communs :
- Asthme allergique : le plus facile à reconnaitre, et le plus fréquent
- Début dans l'enfance
- Histoire d'allergies personnelles ou familiales (eczéma, rhinite, alimentaires, médicaments)
- Inflammation éosinophiles des VA (expectoration induite)
- Bonne réponse aux CSI
- Asthme non allergique :
- Pas d'histoire d'allergie
- Inflammation neutrophile, éosinophile ou paucigranulocytaire
- Mauvaise réponse aux CSI
- Asthme à début tardif :
- Plus fréquent chez les femmes
- Pas d'allergie le plus souvent
- Mauvaise réponse aux CSI (ou besoin de fortes doses)
- Asthme avec limitation des débits fixés :
- Asthmatiques de longue date qui finissent par avoir une obstruction fixée (inflammation chronique ⇒ remaniements bronchiques)
- Asthme et obésité :
- Peu éosinophile
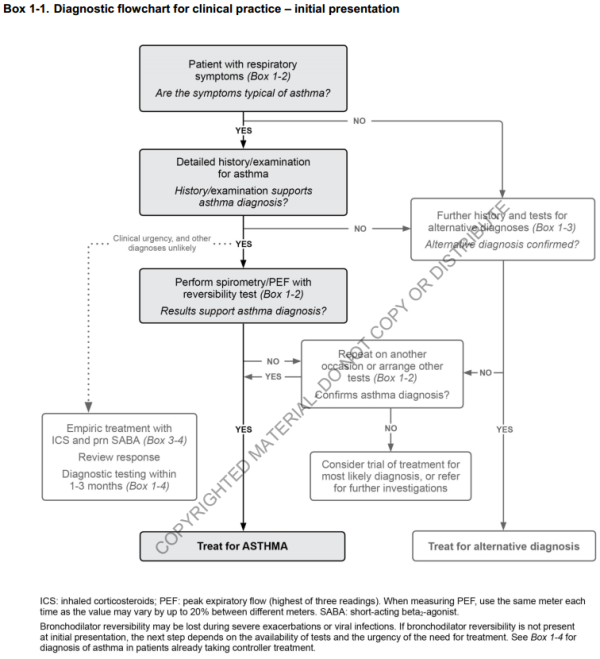
3. Diagnostic de l'asthme
- Identifier : symptomatologie compatible ET limitation variable des débits expiratoires
- Plus difficile chez un patient déjà sous traitement de fond
3.1. Clinique
- Symptômes :
- Patterns typiques : ⇒ augmentent la probabilité d'asthme
- Association (> 1) chez l'adulte surtout de : sibilants, dyspnée, toux, oppression thoracique
- Aggravation la nuit ou au petit matin
- Variabilité
- Facteurs déclenchant (infections virales, exercice, changements météo, rire, expositions (fumée, allergènes, irritants, odeurs fortes))
- Patterns négatifs : ⇒ réduisent la probabilité d'asthme
- Toux isolée
- Expectoration chronique
- Dyspnée avec vertiges, céphalées et paresthésies
- Douleur thoracique
- Dyspnée inspiratoire bruyante déclenchée par l'exercice
- Histoire personnelle et familiale : éléments non spécifiques, et pas présents dans tous les phénotypes
- Début dans l'enfance
- Histoire d'allergie personnelle et/ou familiale (eczéma, rhinite, asthme)
- Examen :
- Souvent normal
- Sibilants le plus souvent, mais peuvent être absents ou discrêts (inspiration forcée)
- Signes de rhinite ou de polypose
- Crépitants ou wheezing inspiratoire ≠ asthme +++
3.2. Para-clinique
3.2.1. Fonction respiratoire
- Peut varier de normal à obstruction sévère
- Asthme mal contrôlé ⇒ plus grande variabilité
- Mesure avant traitement si possible (traitement de fond ⇒ réduit la variabilité)
- VEMS plus fiable que DEP (si DEP utilisé, toujours le même dispositif)
- Prouver la limitation de débit : VEMS/CVF (< 0,75-0,80 chez l'adulte, < 0,90 chez l'enfant)
- Prouver la variabilité : VEMS ou DEP, sur une journée (jour/nuit), d'un jour à l'autre, d'une consultation à l'autre, d'une saison à l'autre, ou avec un test de réversibilité (minute avec SABA, ou en quelques semaines avec traitement de fond)
- Aggravation lors d'une infection respiratoire, même si souvent vu dans l'asthme, n'est pas synonyme d'asthme
- Plus la variabilité est grande, plus le diagnostic est plausible
- Critère de réversibilité : variation > 12% ET 200 cc du VEMS, variation de 20% du DEP (avec symptômes typiques d'asthme) ; quelques exemples typiques :
- Amélioration après bronchodilatateur ou traitement de fond
- Aggravation après exercice ou test de provocation
- Variation spontanée significative sur plusieurs consultations ou auto-mesure à domicile sur 1 ou 2 semaines
- VEMS dans la norme pendant des symptômes ⇒ réduit la probabilité d'asthme
- Réversibilité peut être absente en cas d'infection virale, ou d'utilisation de SABA quelques heures avant
3.2.2. Autres examens
- Test de provocation :
- Sensibilité modérée, spécificité faible
- Un test négatif chez un patient qui ne prend de CSI aide à exclure l'asthme ; un test positif ne peut affirmer l'asthme (diagnostics différentiels : rhinite allergique, fibrose, dysplasie bronchopulmonaire, BPCO)
- Tests allergiques :
- L'atopie chez un patient avec symptômes typiques augmente la probabilité d'asthme allergique ; mais n'est pas spécifique, et n'est pas retrouvée dans tous les phénotypes d'asthme
- Prick tests ou IgE spécifiques. Positivité ne veut pas dire que l'allergène cause les symptômes (la clinique prime)
- FeNO (Exhaled Nitric Oxyde) :
- Chez un adulte, non sous corticoïdes, avec symptômes respiratoires : FeNO > 50 ppb ⇒ bonne réponse à court terme aux CSI
- Mais pas d'étude sur l'arrêt des CSI chez les patients avec FeNO bas
- Non recommandé en pratique
Critères diagnostiques de l'asthme chez l'adulte, l'adolescent et l'enfant de 6 à 11 ans (GINA 2018) :
| Élément diagnostic | Critère de confirmation |
|---|---|
| Symptômes respiratoires variables | |
| Sibilants, dyspnée, oppression thoracique, toux | - En général plus d'un symptôme (toux isolée rarement due à l'asthme chez l'adulte) - Variabilité dans le temps et en intensité - Souvent plus la nuit et au petit matin - Souvent déclenchés par l’exercice, le rire, les allergènes et l'air froid - Souvent aggravés par les infections virales |
| Limitation variable des débits expiratoires | |
| Variabilité excessive documentée ET limitation des débits | - Plus la variabilité et grande et/ou fréquente, plus probable est le diagnostic - VEMS/CVF < 0,75-0,80 au moins une fois |
| Test de réversibilité aux bronchodilatateurs (SABA) | Adulte : augmentation du VEMS > 12% ET 200 cc (encore plus si 15% et 400 cc) Enfant : augmentation de 12% |
| DEP 2x /j | Variabilité > 10% chez l'adulte, > 13% chez l'enfant |
| CSI pendant 4 semaines | Augmentation du VEMS > 12% ET 200 cc (en dehors de toute infection respiratoire) |
| Test d'exercice (exercice challenge test) | Diminution du VEMS de > 10% ET > 200 cc chez l'adulte, > 12% chez l'enfant, ou > 15% du DEP |
| Test de provocation (seulement chez l'adulte en général) | Métacholine ou Histamine : diminution ≥ 20% du VEMS ; Hyperventilation, Sérum salé hypertonique ou mannitol : ≥ 15% |
| Variation entre 2 consultations (moins fiable) | Variation > 12% ET 200 cc du VEMS chez l'adulte (en dehors de toute infection respiratoire) ; > 12% du VEMS ou > 15% du DEP (infections respiratoires tolérées) |
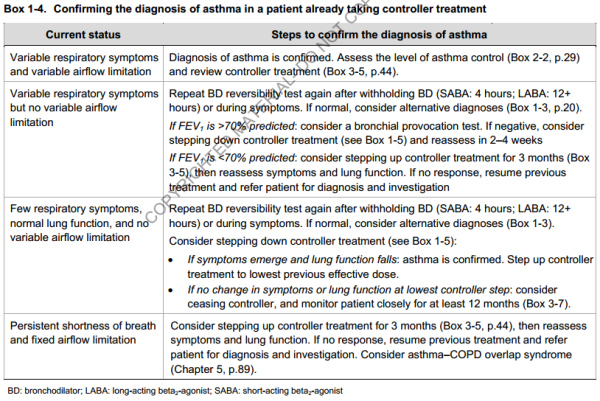
3.3. Cas particuliers
3.3.1. Diagnostic chez un patient déjà sous traitement de fond
- Savoir répéter le test de réversibilité aux SABA, en stoppant tout traitement bronchodilatateurs (SABA: > 4h, LABA: > 12h)
- Tenter des step-up et des step-down du traitement de fond, et ré-évaluer
3.3.2. Toux chronique isolée
- Toux équivalent d'asthme : plus fréquent chez l'enfant, souvent plus problématique la nuit
- La fonction pulmonaire peut être normale
- Il est très important de prouver la variabilité de la fonction respiratoire
- Les autres diagnostics à évoquer sont : toux induite par les IEC, RGO, toux ORL (chronic upper airway cough syndrome ou postnasal drip), sinusite chronique, dysfonction des cordes vocales…
3.3.3. Asthme professionnel, ou aggravé par le travail
- L'asthme peut être induit, ou plus souvent aggravé par les expositions professionnelles (allergènes, irritants…)
- Un rhinite professionnelle peut précéder de plusieurs années l'asthme
- Interrogatoire minutieux et systématique +++
- Des symptômes qui s'améliore durant les vacances ou les week-ends doivent y faire penser
- Démontrer une variabilité de la fonction respiratoire entre le lieu de travail et en dehors (DEP) est très utile au diagnostic
4. Diagnostic différentiel
5. Évaluation de l'asthme
- Doit porter sur :
- Le contrôle de l'asthme (symptômes, et risque future d'évolution défavorable) : évaluer les symptômes sur les 4 dernières semaines, identifier les FDR d'exacerbation, mesurer la fonction respiratoire (au début, après 3 à 6 mois, puis de façon périodique)
- Le traitement : technique d'inhalation, observance, effets secondaires, s'assurer que le patient a un plan d'action écrit
- Les comorbidités : rhinite, sinusite, RGO, obésité, SAOS, dépression et anxiété peuvent aggraver les symptômes (et donc le contrôle) et altérer la qualité de vie
- La fonction respiratoire (VEMS) est très importante pour le risque future
- Contrôle de l'asthme = degré auquel les manifestations de l'asthme sont observée chez un patient, ou sont réduite/supprimée par le traitement ; dépend de l'interaction entre : génétique, physiopathologie de l'asthme (phénotype), traitement, environnement, facteurs psychosociaux
Évaluation du contrôle de l'asthme selon le GINA 2018 :
| Contrôle des symptômes | |
|---|---|
| GINA symptom control tool : durant les 4 dernières semaines : - Symptômes diurnes > 2x/semaine - Réveil nocturne - Traitement de secours > 2x/semaine - Limitation des activités | Bien contrôlé = aucun des items Contrôle partiel = 1 ou 2 Non contrôlé = 3 ou 4 |
| FDR d'évolution défavorable | |
| Évaluation au diagnostic, puis de façon périodique (surtout chez les patients exacerbateurs) VEMS au début, puis après 3 à 6 mois (avoir la meilleur valeur personnelle du patient), puis périodiquement |
|
| FDR d'exacerbations : - Symptômes non contrôlés +++ - Sur-utilisation de SABA (> 1 flacon de 200 doses par mois) - Pas de CSI, mauvaise observance, mauvaise technique d'inhalation - VEMS bas, surtout < 60% - Grande réversibilité du VEMS aux BDs - Problèmes psycho-socio-économiques majeurs - Expositions (tabac, allergènes…) - Comorbidités (obésité, rhino-sinusite, allergie alimentaire) - Éosinophilie sanguine ou de l'expectoration - FeNO élevée (chez l'adulte, allergique, sous CSI) - Grossesse Autres facteurs indépendants : - ATCD d'AAG (intubation) - ≥ 1 exacerbation sévère dans l'année | Un seul de ces facteurs augmente le risque future d'exacerbation, même avec un bon contrôle des symptômes |
| FDR de limitation fixe des débits aériens : - Prématurité, petit poids de naissance - Pas de CSI - Expositions (tabac, irritants…) - VEMS initial bas - Expectoration chronique - Éosinophilie sanguine ou de l'expectoration |
|
| FDR d'effets secondaires aux traitements : - Systémiques : traitement par CSO fréquent, CSI forte dose, inhibiteurs du P450 - Locaux : CSI forte dose, mauvaise technique d'inhalation |
|
5.1. Évaluation du contrôle des symptômes
- Mauvais contrôle des symptômes ⇒ corrélé à augmentation du risque d'exacerbation
- Méthodes simples :
- GINA symptom control tool : bien corrélé aux questionnaires plus élaborés, peut être utiliser (associé à l'évaluation du risque) pour guider les décisions thérapeutiques
- Méthodes plus élaborées (numériques) : fournissent des scores numériques permettant la distinction entre différents niveau de contrôle de l'asthme ; utiles pour suivre les progres du patient ; très utilisés en recherche clinique
- Asthme Control Test (ACT) : score de 5 à 25 (5-15, 16-19, 20-25) ; différence clinique significative ≥ 3 points
5.2. Évaluer le risque future d'évolution défavorable
- On évalue les risques : d'exacerbation, de limitation fixe des débits, et d'effets secondaires des traitements
- Le contrôle des symptômes, même s'il constitue un FDR très important d'exacerbation future, ne peut suffire à lui seul à évaluer ce risque car :
- Les symptômes peuvent être contrôle par un placébo, ou par un LABA seul ⇒ l'inflammation reste non traitée
- Les symptômes peuvent être dus à d'autres facteurs (sédentarité, comorbidités tel qu'une dysfonction des VAS)
- L'anxiété et la dépression peuvent contribuer aux symptômes
- Certains patients ont des symptômes faibles, malgré une fonction respiratoire très altérée
5.3. Rôle de la fonction respiratoire dans l'évaluation du contrôle de l'asthme
- Fonction respiratoire faiblement corrélée aux symptômes
- VEMS bas :
- FDR fort et indépendant d'exacerbation, surtout si < 60%, même si les symptômes sont contrôlés
- FDR de déclin de la fonction respiratoire
- Avec des symptômes discrets, suggère une sédentarité, une mauvaise perception de la limitation des débits, ce qui peut être causé par une inflammation bronchique non traitée
- VEMS normal chez un patient avec des symptômes respiratoires (surtout au moment des symptômes) :
- Considérer d'autres causes aux symptômes (cardiopathie, atteinte ORL, RGO…)
- Réversibilité persistante aux bronchodilatateurs :
- Suggère que l'asthme est non contrôlé
- Sous traitement de fond :
- Le VEMS commence à s'améliorer en quelques jours, puis atteint un plateau en 2 mois environ
- Il est alors utile de mesurer la meilleur valeur personnelle du patient
- Si la limitation des débits devient fixe :
- Il peut être utile de tenter un traitement par CSI+LABA forte dose ou CSI ; si pas d'amélioration, la forte dose ne doit pas être maintenue
- Surveillance du DEP :
- Surveillance à court terme : est utile juste après le diagnostic pour : évaluer la réponse au traitement, les facteurs déclenchant (surtout au travail), établir un plan d'action personnalisé
- Le meilleur DEP est en général atteint après 2 semaines de CSI, la variabilité diminue sur environ 3 mois (si la variabilité excessive persiste ⇒ cela suggère que le contrôle est sub-optimal, et ça augmente le risque d'exacerbation)
- Surveillance à long terme : non recommandée sauf pour les asthmes sévères et les patients avec mauvaise perception de la dyspnée
- Il est utile de rapporter les variations du DEP sur un tableau standardisé
5.4. Évaluation de la sévérité de l'asthme
- Elle se fait de façon rétrospective selon le niveau de traitement requis pour avoir un bon contrôle des symptômes et du risque d'exacerbation ⇒
- Ne peut se faire qu'après avoir obtenu un contrôle durable (quelques mois), et après avoir tenter des step-down à la recherche de la dose minimal efficace
- La sévérité de l'asthme n'est pas statique, et peut évoluer dans le temps (mois, années)
- Asthme léger : paliers 1 et 2
- Asthme modéré : palier 3
- Asthme sévère : paliers 4 et 5
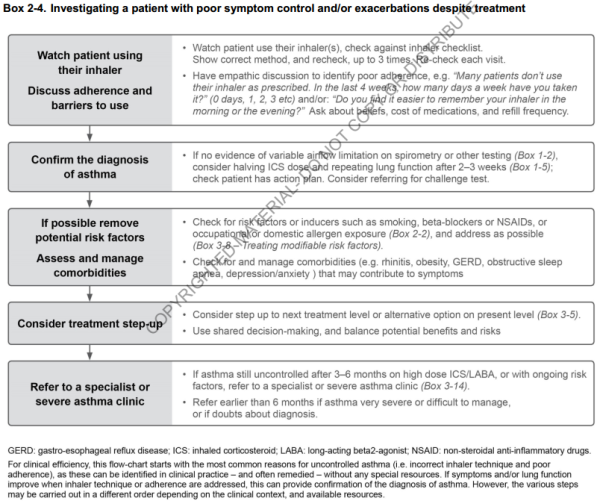
5.4.1. Distinguer asthme non contrôlé et asthme sévère
- Certains patients n'arrivent pas au contrôle des symptômes et du risque d'exacerbation même avec un traitement maximal ; c'est parfois réellement du à l'asthme, mais souvent du à d'autres facteurs (comorbidités, expositions, psycho-sociaux…)
- L'asthme non contrôlé doit être distingué de l'asthme sévère car il est plus souvent la cause de symptômes et d'exacerbations persistantes, et peut être facilement amélioré. Les problèmes les plus fréquemment rencontrés :
- Mauvaise technique d'inhalation (jusqu'à 80% des patients)
- Mauvaise observance
- Diagnostic erroné
- Comorbidités (rhino-sinusite, RGO, obésité, SAOS…)
- Expositions persistantes
- Ce n'est qu'après avoir “régler” tous ces facteurs qu'on peut envisager un step-up du traitement
6. Principes généraux du traitement
6.1. Objectifs au long cours
- Contrôle des symptômes
- Minimiser le risque future d'exacerbation
- Minimiser le risque d'obstruction fixe (ou définitive)
- Minimiser les effets secondaires
- Les objectifs du patient peuvent différer de ceux-ci (il convient d'en prendre compte)
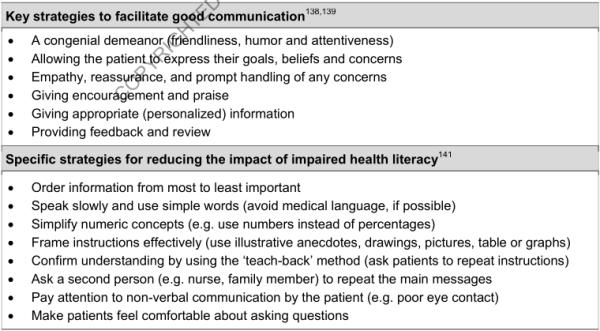
6.2. Relation médecin/patient
- Relation de partenariat ⇒ permet au malade de connaitre sa maladie, et de savoir la gérer
- Bonne communication
- Éducation sanitaire adaptée au contexte (personnel du malade et global de la société)
De la qualité de cette relation dépend en grande partie l'adhérence au traitement et la morbidité.
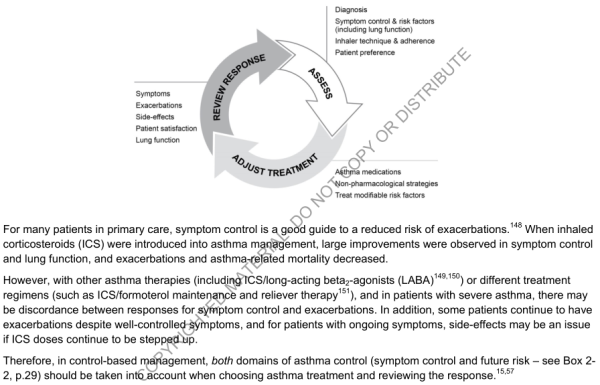
6.3. Prise en charge basée sur le contrôle
- Ajustement continu des traitements (pharmacologiques ou non) en cycle continu :
- Classer : Diagnostic, contrôle des symptômes et facteurs de risque, Technique d'inhalation, préférences du patient ⇒
- Ajuster : Traitements, stratégies non-pharmacologiques, Facteurs de risque modifiable
- Évaluer la réponse : Symptômes, exacerbations, effets secondaires, satisfaction du patient, fonction pulmonaire
- Autres stratégies d'ajustement thérapeutique (non recommandées en routine) :
- Éosinophilie de l'expectoration : moins de risque d'exacerbation avec cette méthode, et contrôle équivalent ; mais peu de centres y ont accès
- Fractional concentration of Exhaled Nitric Oxide (FENO) : moins de risque d'exacerbation (surtout chez l'enfant) ; mais pas encore standardisée (quelle population en tirerai le plus de bénéfice?)
7. Médicaments et stratégies pour le contrôle des symptômes et la réduction des risque
7.1. Médicaments de l'asthme
- Médicaments de contrôle : régulier, réduisent l'inflammation, contrôlent les symptômes, réduisent le risque d'exacerbation future et le déclin de la fonction respiratoire
- Médicaments de secours : prescrits au besoin, indiqués aussi dans la prévention de l'asthme d'effort
- Thérapeutiques annexes : pour les asthmes sévères, après avoir optimiser le traitement (technique, observance) et prise en charge les facteurs de risques modifiables
7.2. Traitement initial
Avant d'entamer le traitement :
- S'assurer du diagnostic
- Évaluer le niveau de contrôle des symptômes et les FDR d'exacerbation (y compris fonction pulmonaire)
- Bien choisir le traitement (dispositif), s'assurer de la technique d'inhalation
- Penser à l'asthme professionnel (éviction)
- Programmer un suivi
Mise en route du traitement de fond :
- Un traitement régulier doit être entrepris le plus tôt possible après diagnostic
- CSI : faible dose plus efficace quand prescrit tôt qu'après 2 à 4 ans d'évolution de l'asthme ; à ce stade, il faut des doses moyennes/fortes pour avoir le même résultat
- Une exacerbation sévère chez un patient sans CSI ⇒ plus grand déclin de la fonction respiratoire qu'avec CSI
- FENO : quand positif (> 50 parts per billion (ppb)) est associer à une bonne réponse aux CSI ; mais la négativité ne permet pas de se passer de CSI
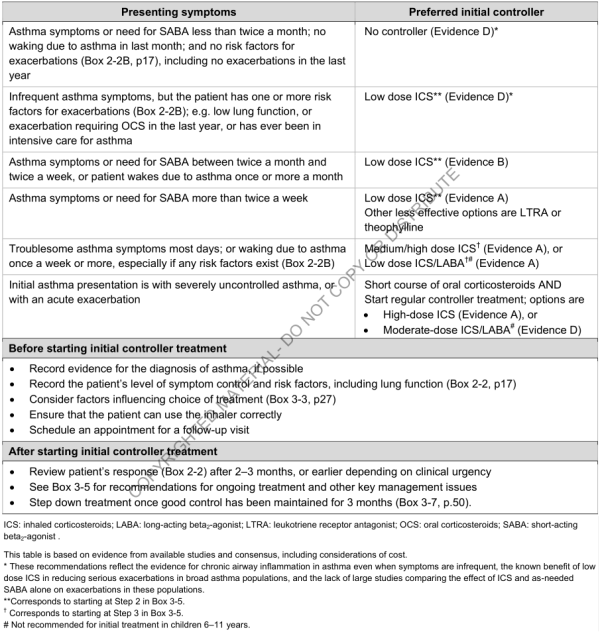
| Tableau | Traitement recommandé |
|---|---|
| Symptômes diurne (ou SABA) < 2 x/mois Pas de symptômes nocturnes Pas de FDR d'exacerbation, pas d'exacerbation (1 an) | Pas de traitement |
| Symptômes diurne > 2x/mois < 2x/semaine OU Symptômes nocturnes = 1 x/mois OU FDR(s) d'exacerbation | CSI faible dose |
| Symptômes (ou SABA) > 2 x/semaine | CSI faible dose Anti-LT ou théophylline |
| Symptômes quasiment chaque jour OU Réveils nocturne = 1 x/semaine Surtout avec FDR d'exacerbation | CSI dose moyenne ou forte CSI+LABA faible dose |
| Asthme sévère non contrôlé, ou exacerbation | CSO, ET CSI forte dose OU CSI+LABA dose moyenne |
Après avoir entamer un traitement :
- Évaluer la réponse après 2 ou 3 mois, ou plus tôt (selon la présentation clinique)
- Ré-ajuster le traitement au besoin (step-up, step-down)
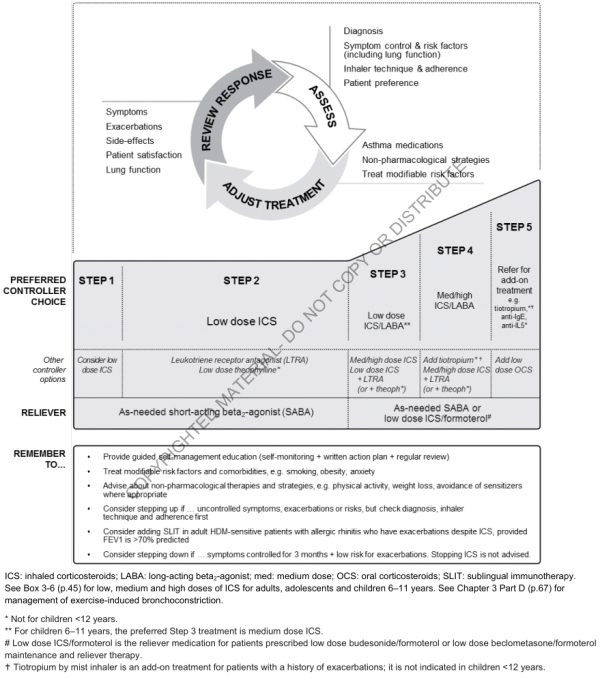
7.3. Ajustement du traitement par paliers
- Symptômes persistants ou exacerbation ⇒ step-up après avoir vérifier :
- Technique d'inhalation
- Observance
- Expositions (allergènes, tabac, pollution, médicaments)
- Comorbidités
- Diagnostic
- Bon contrôle durant 2 à 3 mois ⇒ envisager step-down (recherche de la dose minimale efficace)
- Palier 1 : traitement d'urgence à la demande
- SABA à la demande :
- Pas assez de preuve de sécurité d'utilisation des SABA seuls ⇒ réserver aux asthmes très légers (symptômes occasionnels, de courte durée, pas de symptômes nocturnes, fonction pulmonaire normale)
- Autre option : CSI faible dose ⇒ réduit le risque d'exacerbation
- Autres options non recommandées :
- Anticholinergiques inhalés, SABA oral, théophylline ⇒ non recommandés (début d'action retardé)
- LABA rapides (formoterol) : efficace mais non recommandés (risque de prise de LABA sans CSI ⇒ augmente le risque d'exacerbation)
- Palier 2 : 1 traitement de fond + traitement d'urgence à la demande
- CSI faible dose + SABA :
- Réduction des symptômes, amélioration de la fonction pulmonaire, de la qualité de vie et réduction du risque d'exacerbation, hospitalisation et mortalité
- Autres options :
- Anti-leucotriènes : moins efficaces que les CSI ; quand contre-indication ou problème avec les CSI, ou quand il y a une rhinite allergique associée
- CSI + LABA faible dose : meilleur contrôle des symptômes, mais plus cher et pas plus de réduction du risque d'exacerbation (comparé à CSI seul)
- Asthme purement saisonnier allergique : CSI au début des symptômes, arrêt 4 semaines après la fin de l'exposition (saison pollinique)
- Autres options non recommandées :
- Théophylline : faible efficacité, effets secondaires, toxicité
- Chromones : faible efficacité, sécurité d'emploi, inhalateur peu pratique (nettoyage fréquent)
- Palier 3 : 1 ou 2 traitement(s) de fond + traitement d'urgence à la demande
- 2 options : CSI+LABA faible dose en fond + SABA OU CSI+Formoterol faible dose en fond et symptômes (SMART)
- Associations approuvées (* = SMART) :
- Fluticasone + (formoterol/vilanterol/salmeterol)
- Beclometasone + formoterol (*)
- Budesonide + formoterol (*)
- Mometasone + formoterol
- SMART chez les patients avec FDR ⇒ réduction du risque d'exacerbation, contrôle équivalent (comparé à CSI+LABA dose fixe ou CSI forte dose + SABA)
- Autres options :
- CSI dose moyenne : mois efficace que l'ajout d'un LABA dans ce groupe de patients
- CSI faible dose + anti-LT/théophylline
- Enfant : CSI+LABA faible dose équivalent à CSI seul même dose
- Patients avec rhinite allergique ou allergie aux acariens et persistance des exacerbations avec CSI faible dose : considérer association à Sublingual Allergen Immunotherapie (SLIT), à condition que VEMS > 70%
- Palier 4 : 2 ou plus traitements de fond + traitement d'urgence à la demande
- 2 options : CSI+Formoterol faible dose fond et symptômes OU CSI+LABA dose moyenne + SABA à la demande
- Si exacerbation = 1 x/an ⇒ CSI+LABA faible dose SMART plus efficace pour réduire les exacerbations que CSI+LABA en traitement de fond, même à dose supérieure ; on peut donner dose moyenne/forte de CSI+LABA en fond et dose faible de CSI+LABA en symptôme
- Autres options :
- Ajouter du Tiotropium (LAMA) : contre-indiqué chez l'enfant de moins de 12 ans, améliore légèrement la fonction pulmonaire et le temps avant une exacerbation sévère
- SLIT (même chose qu'au palier 3)
- CSI+LABA forte fose : bénéfice faible en général, augmente le risque d'effets secondaires ; recommander en période d'essai de 3 à 6 mois quand le contrôle n'est pas satisfaisant avec CSI+LABA dose moyenne et/ou un 3e traitement de fond (anti-LT, théophylline)
- Autre traitement qu'on peut associer à un CSI dose moyenne/forte (mais moins efficaces que LABA) : anti-LT, théophylline
- Palier 5 : traitements de haut niveau et/ou traitements adjuvants
- Tiotropium 5µg/j, contre-indiqués chez l'enfant de moins de 12 ans
- anti-IgE (Omalizumab = 6 ans) : asthme allergique modéré à sévère, non controlé au palier 4
- anti-IL5 (Mepolizumab = 12 ans, Reslizumab = 18 ans) ou anti-récepteur-IL5 (Benralizumab = 12 ans) : asthme sévère éosinophilique
- Traitement guidé par l'éosinophilie dans l'expectoration : dans l'asthme sévère, cette stratégie réduit les exacerbation et permet de plus faibles doses de CSI
- Thermoplastie bronchique : effets au long termes inconnus
- Corticothérapie orale (= 7,5 mg/j) : effets secondaires +++ (ostéoporose surtout, traitement adjuvant, adapter les habitudes alimentaires)
7.4. Évaluation de la réponse et ajustement du traitement
Jamais de step-up sans avoir vérifier :
- Que les symptômes sont bien dus à l'asthme
- La technique d'inhalation et l'observance thérapeutique
- Que les facteurs de risques modifiables sont réglés (tabac notamment)
- Contrôle tous les 1 à 3 mois au début, puis tous les 3 à 12 mois ; 1 semaine après une exacerbation
- Step-up :
- Quand le patient ne répond pas (ou pas assez) à un palier donné
- Toujours revoir après 2 ou 3 mois : si pas de réponse ⇒ revenir au palier en dessous ou changer de traitement (alternatif)
- Peut être de courte durée : pendant 1 à 2 semaines (infection virale, exposition allergénique) ; peut être initiée par le patient lui même (plan d'action écrit)
- Voir même au jour le jour : notamment en cas de traitement par ICS+LABA fond et symptômes
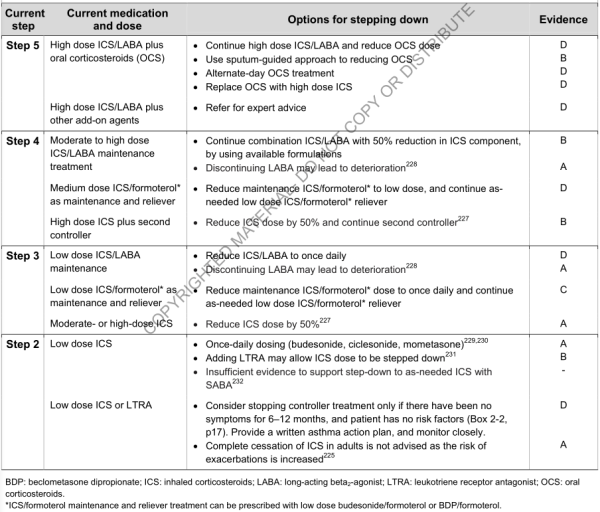
- Step-down :
- 2 buts :
- Trouver la dose minimal efficace (contrôle, risque future, effets secondaires)
- Le fait que le patient sait que s'il prend régulièrement son traitement, cela pourrait amener à réduire les doses peut encourager l'observance thérapeutique
- Principes :
- Quand l'asthme est bien contrôlé et que la fonction respiratoire est stable durant 3 mois au moins
- Si le patient a un trouble ventilatoire fixe ou des facteurs de risques d'exacerbation ⇒ surveillance stricte et rapprochée
- Choisir le bon moment : pas d'infection, pas de voyage, pas de grossesse
- Considérer comme un test thérapeutique, engager le patient : instructions claires (surtout sur quand reprendre la dose d'avant), plan d'action écrit
- Diminution de 25 à 50% de CSI chaque 3 mois ⇒ adapté et sure pour la plupart des patients
- Arrêt complet des CSI n'est pas conseillé (augmentation du risque d'exacerbation) ; peut être envisager seulement si le patient est stable depuis 6 à 12 mois et qu'il n'y a pas de facteur de risque d'exacerbation
7.5. Prise en charge des facteurs de risques modifiables
- Le risque d'exacerbation peut être réduit en assurant un bon contrôle de l'asthme, et en identifiant et traitant les facteurs de risque modifiables :
- Patient avec facteur(s) de risque d'exacerbation : traitement de fond avec CSI, plan d'action, contrôle rapproché, technique et observance
- ≥ 1 exacerbation sévère dans l'année précédent : envisager un régime thérapeutique réduisant le risque d'exacerbation (ex. SMART), step-up si aucun FDR modifiable, identifier les triggers d'exacerbation
- Exposition à la fumée de tabac : arrêt du tabac (consultation), CSI forte dose
- VEMS bas, surtout si < 60% : essayer 3 mois de traitement par CSI forte dose ou 2 semaines de CSO, exclure d'autres pathologies respiratoires (BPCO…)
- Obésité : mesures diététiques, distinguer les symptômes dus au déconditionnement à l'effort, la restriction mécanique et/ou l'apnée du sommeil
- Problèmes psychologiques : prise en charge psychologique, aider le patient à distinguer les symptômes de l'asthme de ceux d'une attaque de panique
- Problèmes socio-économiques : adapter le traitement au budget
- Allergie alimentaire : éviction, adrénaline injectable
- Exposition allergénique : éviction, step-up, ajouter SLIT
- Éosinophilie de l'expectoration : augmenter le CSI même si les symptômes paraissent contrôlés
7.6. Autres thérapeutiques
- Immunothérapie :
- Dans l'asthme allergique (ex. associé à une rhino-conjonctivite allergique)
- Sous cutanée (SCIT) ⇒ associée à une réduction des symptômes et des besoins en médicaments, ainsi qu'à une amélioration de l'HRB spécifique et non spécifique ; attention aux chocs anaphylactiques (rares, mais parfois mortels)
- Ou sub-linguale (SLIT) ⇒ peut être utilisé chez les patients asthmatiques avec sensibilisation aux acariens (documentée) et VEMS > 70% ⇒ réduction des exacerbations légères et modérées
- Vaccinations :
- Antigrippal : conseillée, tout en sachant que cela n'a aucun effet sur la fréquence des exacerbations (ni positif, ni négatif)
- Antipneumococcique : preuves insuffisantes pour le conseiller
- Thermoplastie bronchique :
- Procédure largement associée à l'effet placébo
- Uniquement dans les centres spécialisés, et dans le cadre d'études pour le moment (très peu de recule sur les effets à long terme)
- Vitamine D :
- Un taux faible de vit. D est associé avec une altération de la fonction pulmonaire, plus d'exacerbations et une moins bonne réponse aux corticoïdes
- Pas assez de preuve en faveur de la supplémentation
- Autres (non pharmacologiques) :
- Fumée de tabac
- Activité physique (et prévention de l'asthme d'effort)
- Expositions professionnelles et domestiques
- Éviter les médicaments pouvant induire une exacerbation (AINS…)
- Hygiène de vie (alimentaire +++)
- Éviction allergénique
- Réduction du poids
- Éviter le stresse
| Doses journalières des CSI (µ) | |||
|---|---|---|---|
| Molécule | Faible | Moyenne | Forte |
| Beclometasone dipropionate (CFC) | 200-500 | 500-1000 | > 1000 |
| Beclometasone dipropionate (HFA) | 100-200 | 200-400 | > 400 |
| Budesonide (DPI) | 200-400 | 400-800 | > 800 |
| Fluticasone fuorate (DPI) | 100 | n.a. | 200 |
| Fluticasone propionate (DPI, HFA) | 100-250 | 250-500 | > 500 |
Gaz propulseurs : CFC = chlorofluorocarbon, HFA = hydrofluoroalkane ; DPI = dry powder inhaler
— Résumé basé sur le rapport du GINA 2018
cours/residanat/pneumologie/prise_en_charge_de_l_asthme_au_long_cours.txt · Dernière modification : de admin@medwiki-dz.com